रासायनिक अभिक्रिया और समीकरण,class 10th,BOARD EXAM 2024( इंसान में अगर इच्छा सकती हो तो दुनिया में कुछ भी संभव नहीं है)BY:SUJEET SIR,9709622037,ARARIA,BIHAR
1. रासायनिक अभिक्रियाएँ और समीकरण
रासायनिक अभिक्रियाः वह प्रक्रिया जिससे दो या दो से अधिक उत्पाद मिलकर एक या एक से अधिक गुणधर्म वाले नए पदार्थ का निर्माण करते है तो उसे रासायनिक अभिक्रिया कहते है |
जैसे:
2H2 + O2 → 2H2O (यहाँ हाइड्रोजन और ऑक्सीजन एक रासायनिक अभिक्रिया में भाग लेकर एक नए गुणधर्म वाले पदार्थ का निर्माण करते है जो जल (H2O) है,
> हमारे आस-पास ऐसी बहुत सारी परिवर्तनें होती रहती है
•
•
जैसे :
वायु के संपर्क में आने से जंग का लगना |
भोजन का पकना |
हमारे शारीर में भोजन का पचना |
हम जो श्वसन करते है |
रासायनिक अभिक्रिया की पहचान
रासायनिक अभिक्रिया की पहचान करना ताकि यह पता लगाया जा सके कि अभिक्रिया सम्पन्न हुआ है | जब कोई अभिक्रिया संपन्न होता है तो उसे निम्न चिन्हों से पहचाना जाता है ।
जैसे :
•
पदार्थ की अवस्था में परिवर्तन |
.
रंग में परिवर्तन |
•
गैस का निष्कासन |
ताप में परिवर्तन |
रासायनिक समीकरण:
रासायनिक समीकरण किसी रासायनिक अभिक्रिया को समीकरण के रूप में निरूपण रासायनिक समीकरण कहलाता है रासायनिक समीकरण दो तरीके से लिखा जा सकता है
1. शब्द समीकरण
2. सांकेतिक समीकरण
शब्द समीकरण :-
सांकेतिक समीकरण :-
मैग्नीशियम + ऑक्सीजन मैग्नीशियम ऑक्साइड (इस प्रकार समीकरणों को लिखना शब्द समीकरण कहलाता है)
2Mg + O2 2Mgo
( इस प्रकार समीकरणों को लिखने का सांकेतिक तरीका है)
रासायनिक अभिक्रिया के समीकरणों के भाग :- रासायनिक अभिक्रिया के समीकरणों के दो भाग होते है |
(1) अभिकारक : वे पदार्थ जो किसी अभिक्रिया में भाग लेते है अभिकारक कहलाते है |
जैसे -
Mg + O2 Mgo ( अभिकारक )
ऊपर के समीकरण में मैग्नीशियम एवं ऑक्सीजन अभिक्रिया में भाग लेते है इसलिए ये दोनों अभिकारक है |
(2) उत्पाद : किसी अभिक्रिया के दौरान नए बनने वाले पदार्थों को उत्पाद कहते है |
जैसे -
Mg + O2 -------Mgo (उत्पाद)
जैसे -
Mg + O2 -------Mgo (उत्पाद)
MgO उत्पाद है जो Mg और O2 के भाग लेने से नया पदार्थ बना है ।
रासायनिक समीकरणों को लिखना :
रासायनिक समीकरण एक रासायनिक अभिक्रिया को प्रदर्शित करता है | इसलिए रासायनिक समीकरण में तीर के निशान के बायीं ओर अभिकारकों को लिखा जाता है और उनके बीच में (+) चिन्ह लगाया जाता है, इसीप्रकार तीर के दाई ओर उत्पादों को लिखा जाता है और उनके बीच (+) चिन्ह लगाया जाता है |
Zn + H2SO4 -------ZnSO4 + H2
इसको समझिये :
[अभिकरकों के बीच (+) चिन्ह ]
[उत्पादों के बीच (+) चिन्ह]
बायीं ओर
दायीं ओर
तीर
रासायनिक अभिक्रियाएं में अवस्था परिवर्तन को प्रदर्शित करना :-
रासायनिक समीकरण में तत्वों के प्रतीक के रासायनिक सूत्र उनकी अवस्था जैसे ठोस ( s), द्रव ( । ), गैस ( g ) के साथ लिखे होते हैं
इसके अलावा आवश्यक परिस्थितियों जैसे तापमान, दाब, उत्प्रेरक इत्यादि को तीर के निशान के ऊपर या नीचे दिखाया जाता है।
रासायनिक अभिक्रियाओं के प्रकार:
रासायनिक अभिक्रियाएँ निम्न प्रकार की होती है |
(1) संयोजन अभिक्रिया ( Combination Reaction )
(2) वियोजन या अपघटन अभिक्रिया ( Decomposition Reaction ) (3) विस्थापन अभिक्रिया (Displacement Reaction )
(4) द्वि-विस्थापन (Double Displacement Reaction )
(5) उपचयन एवं अपचयन ( Oxydation and Reduction Reaction )
ऊष्मा के आधार पर रासायनिक अभिक्रिया के प्रकार :
(6) ऊष्माक्षेपी अभिक्रियाएँ (Endothermic Reaction) (7) ऊष्माशोषी अभिक्रियाएँ (Exothermic Reaction)
1. संयोजन अभिक्रिया (Combination Reaction)
वह अभिक्रिया जिसमें दो या दो से अधिक अभिकारकों से एक एकल उत्पाद का निर्माण होता है तो ऐसी अभिक्रिया को संयोजन अभिक्रिया कहते है ।
उदाहरण:
a. कोयले का जलना
C(s) + O2 (g ) ------CO2 (g)
b. जल का बनना
2H2 (g ) + O2 (g ) → 2H2O (I)
c. सल्फर डाइऑक्साइड का बनना
S(s) + O2 (g ) SO2 (g )
2. वियोजन या अपघटन अभिक्रिया (Decomposition Reaction):
वे अभिक्रियाएँ जिनमें एकल अभिकारक वियोजित / विघटित होकर दो या अधिक उत्पादों का निर्माण करता है । विघटन अभिक्रियाएँ कहलाती है |
विघटन अभिक्रियाएँ तीन प्रकार के होती है।
a. ऊष्मीय वियोजन इसमें वियोजन की क्रिया ऊष्मा (Heat) के द्वारा होता है।
उदाहरण:
(i)
2 Fe SO 4------ऊष्मा---------Fe2O 3+ SO2 + SO3
(ii)
CaCO3------ऊष्मा ---- CaO + CO2
b. विद्युत वियोजन : इसमें ऊष्मा विद्युत (electricity) के रूप में प्रदान की जाती है ।
उदाहरण:
(i)
2H2O------- विद्युत---2 H2 + O 2
c. प्रकाशीय वियोजन : जब वियोजन की क्रिया के लिए ऊष्मा प्रकाश के द्वारा प्रदान की जाती हैं।
उदाहरण:
(i)
2 AgCl----सूर्य का प्रकाश-----2Ag + Cl2
(ii)
2 AgBr----सूर्य का प्रकाश--- 2Ag + Br2
3. विस्थापन अभिक्रिया (Displacement Reaction) :-
ऐसी अभिक्रियाएँ जिसमें अधिक अभिक्रियाशील पदार्थ कम अभिक्रियाशील पदार्थ को उसके यौगिक से अलग कर देता है। विस्थापन अभिक्रिया कहलाती हैं।
उदाहरण:
Fe(s) + CuSO4 (aq)----FeSO4 (aq) + Cu (s)
कॉपर सल्फेट फेरस सल्फेट
4. द्वि-विस्थापन अभिक्रिया (Double Displacement Reaction) :
ऐसी अभिक्रिया जिसमें अभिकारक के बीच आयनों का आदान-प्रदान होता है द्वि-विस्थापन अभिक्रिया कहलाता है | द्वि-विस्थापन अभिक्रिया के लिए सामान्य सूत्र:
5. उपचयन एवं अपचयन अभिक्रिया (Oxidation And Reduction):
उपचयन (Oxidation Reaction): किसी पदार्थ में ऑक्सीजन की वृद्धि अथवा हाइड्रोजन का ह्रास होता है अथवा दोनों हो तो इसे उपचयन कहते हैं।
अपचयन अभिक्रिया (Reduction Reaction): किसी पदार्थ में हाइड्रोजन की वृद्धि अथवा ऑक्सीजन का हास अथवा दोनों हो तो इसे अपचयन कहते है |
ऊष्मा के आधार पर रासायनिक अभिक्रिया के प्रकार :
(6) ऊष्माक्षेपी अभिक्रियाएँ : वे अभिक्रियाएँ जिसमें अभिक्रिया के दौरान ऊष्मा निकलती है, ऊष्माक्षेपी अभिक्रिया कहलाती हैं ।
उदाहरण:
(6) ऊष्माक्षेपी अभिक्रियाएँ : वे अभिक्रियाएँ जिसमें अभिक्रिया के दौरान ऊष्मा निकलती है, ऊष्माक्षेपी अभिक्रिया कहलाती हैं ।
उदाहरण:
a. CH4(g) + 2O2(g) CO2 (g) + 2H2O(g) + ऊष्मा
b. श्वसन भी एक ऊष्माक्षेपी अभिक्रिया का उदाहरण है
जिसमें कोशिकाएँ श्वसन के दौरान ऊष्मा मुक्त करती है।
c. शाक सब्जियों या सड़े-गले घास-फूस या पेड़ों के पत्तों का विघटन होकर कम्पोस्ट का बनना ।
(7) ऊष्माशोषी अभिक्रियाएँ : वे अभिक्रियाएँ जिसमें ऊष्मा का शोषण होता है। ऊष्माशोषी अभिक्रिया कहलाती हैं ।
उदाहरण:
रेडोक्स अभिक्रिया (Redox Reaction):
ऐसी अभिक्रिया जिसमें अभिक्रिया के दौरान एक अभिकारक उपचयित होता है जबकि दूसरा अपचयित होता है उसे रेडोक्स अभिक्रिया कहते हैं।
दुसरे शब्दों में;
जब किसी अभिक्रिया के दौरान उपचयन की क्रिया एवं अपचयन की क्रिया एक साथ होता हो उसे रेडोक्स अभिक्रिया कहते हैं |
ऑक्सीकारक (Oxidising Agent / Oxidants/Oxidisers) :
वह पदार्थ जो उपचयन के लिए ऑक्सीजन देता है या अपचयन के लिए हाइड्रोजन को हटाता है, ऑक्सीकारक कहलाता है
अवकारक (Reducing agent):
वह पदार्थ जो ऑक्सीजन के हटने के लिए उत्तरदायी होता है अथवा अपचयन के लिए हाइड्रोजन देता है, अवकारक कहलाता है |
(a) उपचयित पदार्थ : H2
(b) अपचयित पदार्थ : Cuo (c) ऑक्सीकारक : Cuo
(d) अवकारक: H2
Addition of oxygen - Oxidation
जिसमें ऑक्सीजन की वृद्धि होती है |
जिससे ऑक्सीजन का ह्रास होता है |
→ जो उपचयन के लिए ऑक्सीजन प्रदान करता है।
→
जो ऑक्सीजन के ह्रास के लिए उत्तरदायी है |
उपचयन का प्रभाव:
हमारे दैनिक जीवन में ऐसी बहुत सी अभिक्रियाएँ हमारे आस-पास होती रहती है जिसमें से धातुओं का संक्षारण एवं खाद्य पदार्थो का विकृतगंधित हो जाना सामान्य उदाहरण है जो उपचयन अभिक्रिया के प्रभाव से होता है ।
हमारे दैनिक जीवन में ऐसी बहुत सी अभिक्रियाएँ हमारे आस-पास होती रहती है जिसमें से धातुओं का संक्षारण एवं खाद्य पदार्थो का विकृतगंधित हो जाना सामान्य उदाहरण है जो उपचयन अभिक्रिया के प्रभाव से होता है ।
1. संक्षारण (Corrosion):
वह प्रक्रिया जिसमें हवा, जल एवं नमी के संपर्क में आकर धातु की सतह धीरे-धीरे ह्रास होने लगता है, इस प्रक्रिया को संक्षारण कहते है |
संक्षारण से बचाव (Preventing Corrosion):
संक्षारण से बचाव की निम्न विधियाँ हैं |
(i) जस्तीकरण (galvanization)
(ii) धातु की सतह को पेंट करके
(iii) धातु की सतह पर तेल लगाकर या ग्रीस लगाकर
(iv) जस्तीकरण (Galvonisation): किसी धातु की सतह पर विध्युत लेपन द्वारा जस्ते (zinc) की पतली परत चढाने की प्रक्रिया को जस्तीकरण कहते है |
2. विकृतगंधिता (Rancidity):
भोजन में उपस्थित वसा एवं तेल का वायुजनित उपचयन जिससे उसका स्वाद एवं गंध बदल कर बदबूदार हो जाता है भोजन का इस प्रकार ख़राब होना विकृतगंधिता कहलाता है |
भोजन में उपस्थित वसा एवं तेल का वायुजनित उपचयन जिससे उसका स्वाद एवं गंध बदल कर बदबूदार हो जाता है भोजन का इस प्रकार ख़राब होना विकृतगंधिता कहलाता है |
वसा एवं तेलीय खाद्य पदार्थ का विकृतगंधिता से बचाव:
इसको रोकने की निम्न विधियाँ हैं।
(i) वसा एवं तेलीय खाद्य पदार्थों में एंटी-ऑक्सीडेंट (anti-oxidants) डालने से इसे विकृतगंधित होने से बचाया जा सकता है |
(ii) खाद्य पदार्थों के पैकिंग के समय बर्तन से ऑक्सीजन गैस को हटा कर नाइट्रोजन गैस से भरा जाता है | इससे विकृतगंधित होने से बचाया जा सकता है |
(iii) उपचयन की दर को कम करने के लिए वायु-मुक्त बर्तन में खाद्य पदार्थों को रखने से विकृतगंधित होने की दर को कम किया जा सकता है |
(I V)खाद्य पदार्थों को विकृतगंधिता से बचाने के लिए एवं उसकी दर को कम करने के लिए रेफ्रीजेरेटर में रखा जाता है |
रासायनिक समीकरण को संतुलित करना :
जैसा कि हम जानते हैं : द्रव्यमान संरक्षण नियम के अनुसार किसी भी रासायनिक अभिक्रिया में द्रव्यमान का न तो निर्माण होता है न ही विनाश होता है । इसलिए अभिक्रमक और उत्पादों का द्रव्यमानहमेशा बराबर होना चाहिए। इसलिए रासायनिक अभिक्रिया के पहले एवं उसके बाद में प्रत्येक तत्वों के परमाणुओं की संख्या समान होनी चाहिए। । रासायनिक अभिक्रिया जिसमें अभिकमक तथा उत्पाद के प्रत्येक तत्वों के परमाणुओं की संख्या बराबर होती है, संतुलित अभिक्रिया कहलाती हैं।
उदाहरण
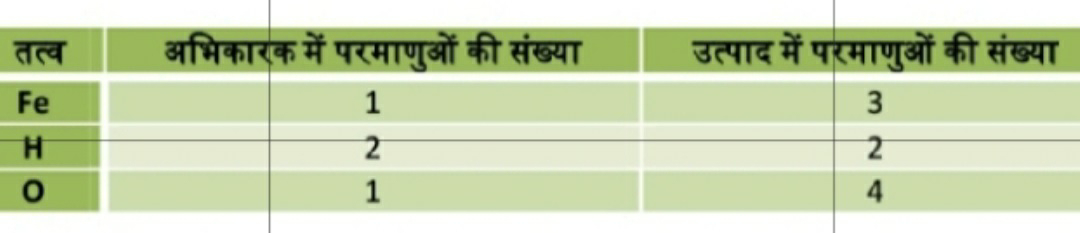
Fe + H2O → Fe3O4 + H2 को लेते है |
Steps: (i) प्रत्येक सूत्र बॉक्स में लिखिए बॉक्स के अन्दर कोई भी बदलाव नहीं होना चाहिए यह आपको ध्यान देना है ।
Steps: (ii) असंतुलित समीकरण में उपस्थित विभिन्न प्रकार के तत्वों के परमाणुओं का सूचि बनाइए एवं गिनती कीजिए | इस प्रकार से
पहले ये देखिए कि किस तत्व के परमाणुओं की संख्या सबसे अधिक है । यह अभिकारक या उत्पाद की ओर से हो सकता है यौगिक Fe3O4 में O तत्व के सबसे अधिक 4 परमाणु हैं ।
ऑक्सीजन के परमाणुओं की संख्या को बराबर करने के लिए, H2O के साथ गुणांक 4 लगाते है जिसे इस प्रकार 4H20 लिखेंगे | तब हमें यह समीकरण प्राप्त होता है |
Fe + 4 H20 Fe3O4 + H2
Steps:( i ) अगला अधिकतम परमाणुओं वाला तत्व Fe है | जिसे ठीक उसी नियम से संतुलित करना है | अभिकारक की ओर Fe के साथ गुणांक 3 लगाने पर 3Fe प्राप्त होता है, तब समीकरण होगा |
3 Fe + 4 H20 -------Fe3O4 + H2
Steps: (iv) अंत में हम दोनों पक्षों के हाइड्रोजन परमाणुओं को संतुलित करना है |
3 Fe + 4 H20 -----Fe3O4 + 4 H2
अब हम यह देखते है कि यह समीकरण पूरी तरह संतुलित है ।
Steps:(v) अभिकारकों और उत्पादों की भौतिक अवस्था को दर्शाना । रासायनिक अभिक्रिया में तत्वों की भौतिक अवस्था को दर्शाने के लिए निम्न चिन्हों का उपयोग किया जाता है ठोस - ( s), द्रव - ( 1 ), गैस - ( g ) - अवस्था जलीय विलियन - ( aq ) इसके अलावा कुछ आवश्यक परिस्थितियां जैसे रासायनिक अभिक्रिया के लिए तापमान, दबाव या उत्प्रेरक की उपस्थिति को तीर के निशान के ऊपर या नीचे लिखा जाता
वक्त मिलता है जिंदगी को बदलने के लिए लेकिन जिंदगी नहीं मिलता वक्त को बदलने के लिए
कड़ी से कड़ी जोड़ने जाओ तो जंजीर मिल जाती है मेहनत पर मेहनत करते जाओ तो मंजिल मिल जाती है
BY:SUJEET SIR,9709622037,ARARIA,BIHAR
अगर आपको अच्छा लगा हो तो अपने दोस्तों के साथ शेयर करें










टिप्पणियाँ
एक टिप्पणी भेजें